原子と分子と電子
原子と分子
原子が集まって分子になる
地球上に存在する物質はすべて分子から成っています。
水で言えば、水の性質を失わない範囲で細かくしていったとき、それ以上細かく出来ない状態の最小の粒子を分子といいます。コップに入った水を細かくしていくと水滴になります。それをもっと細かくして、目に見えない大きさになっても細かくし続けていくと、最終的には水の分子になります。
水の分子は、化学式ではH2Oと表し、水の分子をさらに分解するとHとOに分かれます。Hは水素、Oは酸素です。このHとOのような物質を元素といい、元素はほかにも炭素・窒素・ナトリウム・カルシウム・金・銀・銅・鉄・アルミニウムなど100種類以上存在しています。
そして元素の単体を原子といい、地球上にあるさまざまな物質は原子からできています。地球上には元素は100種類程度しか存在しません。この元素がいろいろな形に組み合わさって、膨大な種類の物質を作り出しているのです。
電子と陽子
原子の構造
原子は非常に小さなものです。種類によりますが、大きさは約10-9[m]です。その小さな原子の中心には原子核があり、原子核の周りに電子が取り巻いています。原子核を中心とした球殻状の軌道が何重にもあり、その軌道上に電子が存在します。原子核を太陽、電子を惑星と考えると、原子の構造は太陽系に似ています。
図1
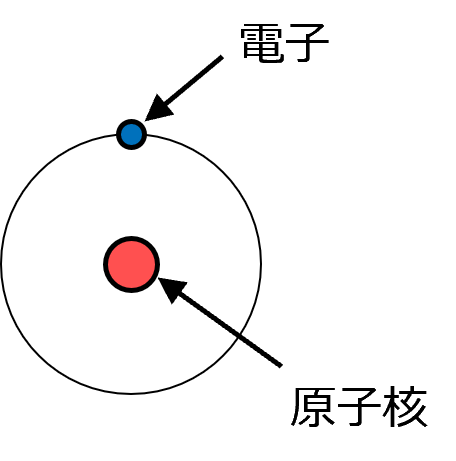
図1は水素原子の構造です。
水素原子の原子核は、1つの陽子でできていますが、他の原子の原子核は陽子と中性子が集まって出来ています。陽子と中性子は核子といいます。
陽子や中性子は大きさが約10-15[m]で、重さは陽子が1.673×10-27[kg]、中性子が1.675×10-27[kg]です。原子核の周りをまわっている電子の重さは9.109×10-31[kg]です。
水素の原子は1個の電子を持っています。原子が持っている電子の数は原子番号からわかります。
原子番号と原子は、
1 水素
2 ヘリウム
3 リチウム
4 ベリリウム
5 ホウ素
6 炭素
7 窒素
8 酸素
9 フッ素
10 ネオン
と続きます。
この原子番号は、その原子の電子の数を表しており、水素は1個の電子を持っています。
陽子は正電荷を、電子は負電荷を持っています。中性子はその名の通り、正電荷も負電荷も持っておらず、中性の状態です。
陽子の持つ正電荷の量は1.602×10-19[C]、電子が持つ負電荷の量は-1.602×10-19[C]となっており、量は同じですが正負が反対になります。通常状態の原子は、陽子と電子のが同数になっていて、正電荷と負電荷の量も同数になるため、電気的に±0になっています。
電子の特徴
図2
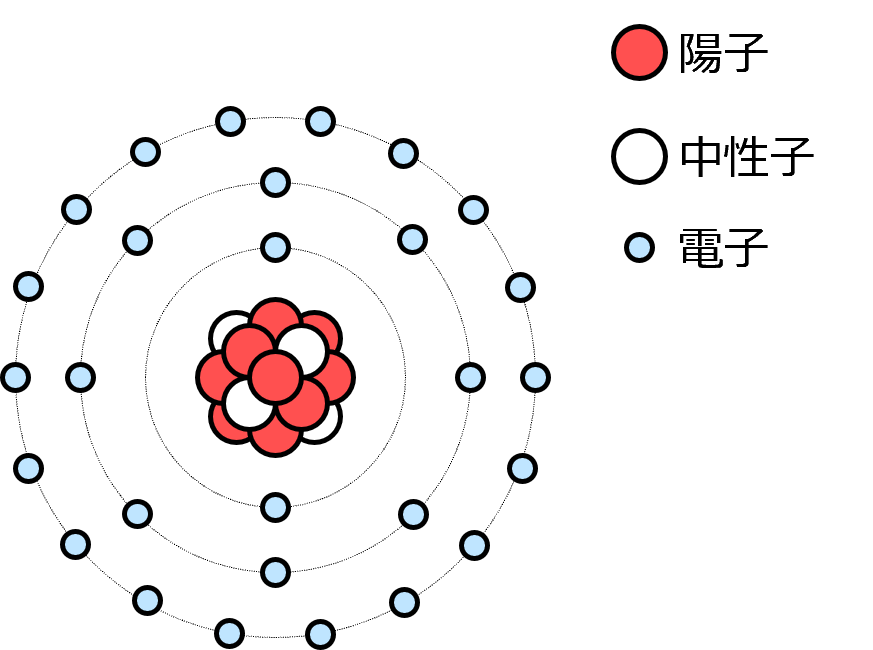
図2は原子の構造です。
原子核の周りを取り巻く電子は、原子核を中心とした球殻状の軌道に配置されています。この球殻は何重にもなっていて、内側からK殻、L殻、M殻と名前がついています。それぞれの球殻は配置できる電子の数に限度があり、K殻の定員は2個、L殻の定員は8個、M殻の定員は18個となっています。
原子が持っている電子は内側の球殻から順番に配置され、その球殻の定員を超える場合は、次の球殻に電子が配置されます。リチウムの原子は3つの電子を持っていますので、K殻に2つ、L殻に1つという形で電子が配置されています。
イオン
電子の球殻状の軌道のうち、最も外側の軌道に配置された電子を価電子といいます。また、最も外側の軌道にある電子の数を価電子数といいます。
価電子数が、最も外側の球殻の定員と一致している場合は原子は安定して化学反応を起こしにくくなります。
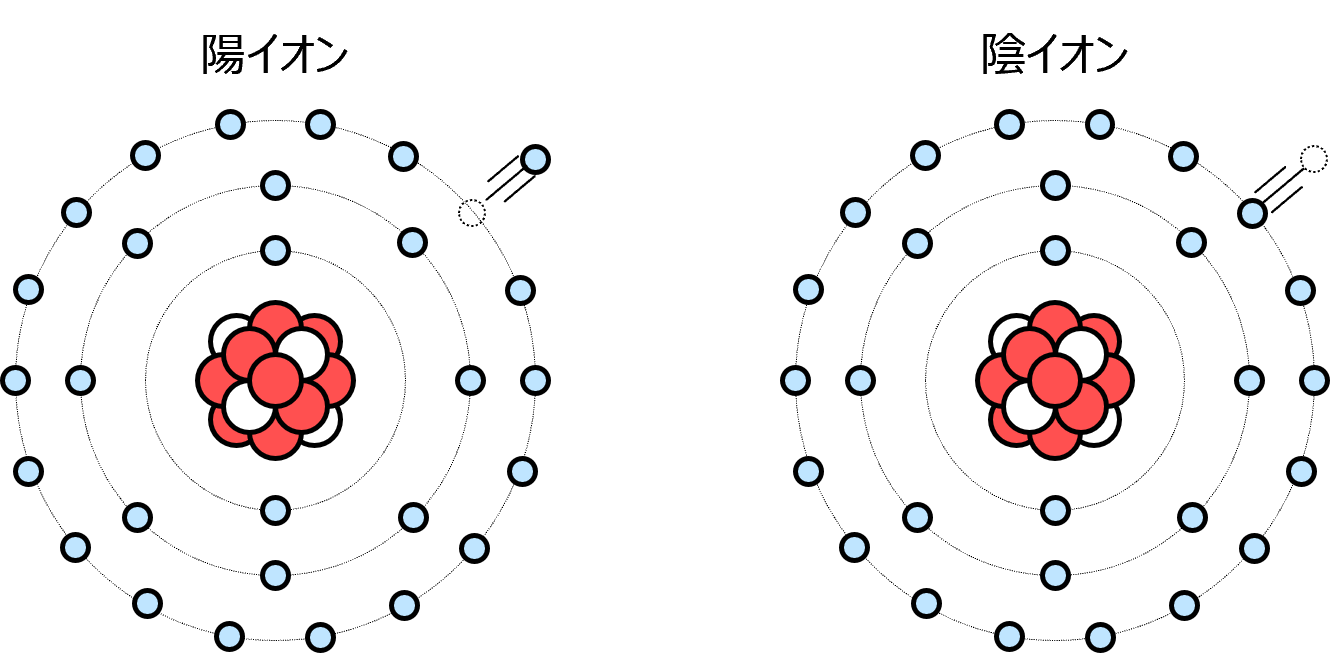
原子は安定を求める性質があるため、価電子が1個のときは価電子が軌道を外れて飛んでいきやすくなり、逆に価電子が最大数より1個少ないときは外から電子が飛び込みやすい状況になっています。
電気的に中性であった原子から価電子が飛んでいってしまうと、ーの電気を持っている電子に比べて、+の電気を持っている陽子の数が多くなるため、原子全体としては+の電気を持つことになり、このような状態の原子を+イオンといいます。反対に、電気的に中性であった原子に電子が飛びこんでくると、陽子の数に比べて電子の数が多くなるため、原子は−の電気を持つことになり、このような状態の原子を−イオンといいます。
図3
TOPページに戻る
サイト内検索
電気とはなにか
電気の歴史
電荷
電気力線と電束
原子と分子と電子
電気の回路と水の回路
電流とは
電圧とは
抵抗とは
電力と電力量
直列・並列接続の合成抵抗
分圧と分流
直流と交流
正弦波交流
抵抗・リアクタンス・インピーダンス
電界と磁界
磁荷
磁力線と磁束
磁気ヒステリシス
コイルとインダクタンス
コンデンサと静電容量
共振
力率と皮相・有効・無効電力
零相電流とI0r・I0c
3相交流
ベクトル図の使い方
電線にとまった鳥が感電しない理由
需要率と負荷率と不等率
パーセントインピーダンス法(%Z)
ホイートストンブリッジ
スターデルタ変換・デルタスター変換
電圧降下
過渡現象
過渡現象(R-L直列回路)
過渡現象(R-C直列回路)
原子力発電の仕組み
水力発電の仕組み
火力発電の仕組み
太陽光発電の仕組み
関東と関西で周波数が違う理由
なぜ交流送電なの?
停電
瞬時電圧低下
受電方式
スポットネットワーク受電方式の仕組み
ループ受電方式の仕組み
進相コンデンサと力率割引
遮断器と開閉器と断路器
開閉サージ
GIS(ガス絶縁開閉装置)
UGS・UAS・PGS・PAS
保護継電器
変圧器(トランス)
励磁突入電流
接地(アース)
統合接地
接地用補償コンデンサ
電源冗長化
フェランチ効果
オームの法則
クーロンの法則
キルヒホッフの法則
ファラデーの法則・レンツの法則
フレミングの法則
ミルマンの定理
テブナンの定理
ガウスの定理
重ね合わせの理
アンペア周回積分の法則
ビオ・サバールの法則
第3種電気主任技術者 理論
第3種電気主任技術者 電力
第3種電気主任技術者 機械
第3種電気主任技術者 法規
第2種電気主任技術者 1次理論
第1種電気主任技術者 1次理論
第1種電気主任技術者 1次電力
第1種電気主任技術者 1次機械
第1種電気主任技術者 1次法規
第1種電気主任技術者2次試験 電力・管理
第1種電気主任技術者2次試験 機械・制御
エネルギー管理士(電気) 電気の基礎
技術士一次試験 共通科目数学
技術士一次試験 共通科目物理
技術士一次試験 共通科目化学
技術士一次試験 基礎科目
技術士一次試験 電気電子部門 専門科目
技術士一次試験 適性科目
技術士二次筆記試験 電気電子部門 必須科目
技術士二次筆記試験 電気電子部門 選択科目 発送配変電
技術士二次筆記試験 電気電子部門 選択科目 電気応用
技術士二次筆記試験 電気電子部門 選択科目 電子応用
技術士二次筆記試験 電気電子部門 選択科目 情報通信
技術士二次筆記試験 電気電子部門 選択科目 電気設備
技術士二次筆記試験 総合技術監理部門 必須課目
